Por lo general, los proveedores de atención médica, los investigadores o las personas autorizadas que conocen y comprenden el tratamiento, el procedimiento o el estudio obtienen el consentimiento informado. Son responsables de proporcionar la información necesaria y responder a las preguntas para garantizar la comprensión de la persona.

Carta de consentimiento informado
Garantice la claridad y la transparencia con nuestra carta de consentimiento informado, que permite a sus clientes tomar decisiones informadas con respecto a su participación.
Carta de consentimiento informado Template
Commonly asked questions
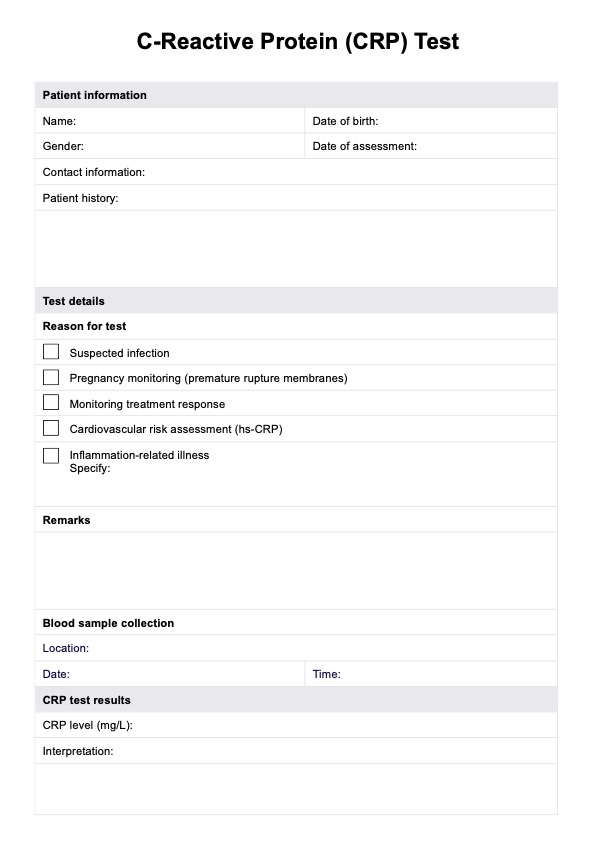
Un formulario de consentimiento informado debe incluir detalles sobre el propósito del tratamiento o estudio, los posibles riesgos y beneficios, las alternativas, las medidas de confidencialidad, las consideraciones financieras (si corresponde) y la naturaleza voluntaria del consentimiento. También debe permitir la firma de la persona para reconocer su comprensión y acuerdo.
La persona puede retirar el consentimiento informado en cualquier momento durante el tratamiento, el procedimiento o el estudio. Las personas pueden cambiar de opinión o dejar de participar sin consecuencias negativas para su atención o tratamiento futuros.
EHR and practice management software
Get started for free
*No credit card required
Free
$0/usd
Unlimited clients
Telehealth
1GB of storage
Client portal text
Automated billing and online payments